با خواندن مطالب زیر به آسانی با علوم هشتم فصل 2 آشنا می شوید.
علوم هشتم فصل 2 : تغییرهای شیمیایی در خدمت زندگی
در فصل قبل با مفاهیم فصل اول علوم هشتم آشنا شدیم. در این فصل به بررسی علوم هشتم فصل 2 (تغییرهای شیمیایی در خدمت زندگی) می پردازیم.
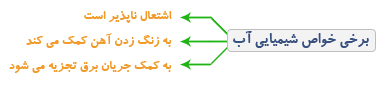
تغییرهای شیمیایی می توانند مفید یا مضر باشند؛ مثال هایی از تغییرات مضر :
- ترش شدن شیر
- زنگ زدن درب آهنی
- سیاه شدن ظرف نقره ای
- تغییر رنگ فرش مقابل نور
مثال هایی از تغییرات مفید: پختن غذا ، گوارش و هضم غذا، مواد در حال تغيير
مواد پيرامون ما پيوسته در حال تغيير هستند. انجماد آب ، زنگ زدن آهن شكستن شيشه، ذوب يخ، تغيير رنگ پارچه ها، ترش شدن شير، هضم غذا و … از جمله تغييرات مواد هستند.
برخي از اين تغييرات سودمند و برخي زيان آورند.
ما پيوسته در پي آن هستيم كه تغييرات مطلوب را پديد آوريم و از بروز تغييرات نامطلوب جلوگيري كنيم.
الف) تغيير فيزيكي:
در اين نوع تغيير شكل، اندازه و حالت ماده تغيير می كند. اما خواص و ماهيت ماده تغيير نمی كند.
تبخير، تصعيد ، ميعان و ساير تغيير حالت ها و نيز خرد شدن ، سائيدن و … از جمله تغييرات فيزيكي هستند.
ب) تغییرهای شیمیایی:
به تغييری گفته مي شود كه در نتيجه آن خواص و ماهيت ماده تغيير می كند و ماده يا موادی با خواص جديد حاصل مي شود.
هنگامي كه آب به كمك جريان الكتريسيته تجزيه مي شود گازهای هيدروژن و اكسيژن پديد می آيند اين دو ماده هيچ شباهتی با آب ندارند.
سوختن چوب، زنگ زدن آهن، تغيير رنگ پارچه، زرد شدن برگ درختان، هضم غذا، تبديل شدن شير به ماست و پنير از جمله تغييرات شيميايی هستند.
خواص ماده در علوم هشتم فصل 2 :
هر ماده دارای خواصی است كه با آنها شناخته مي شود .
مثلا بي رنگ بودن خاصه آب ، شور بودن خاصه نمك، اشتعال پذير بودن خاصه كاغذ و تمايل به زنگ زدن خاصه آهن است.
الف) خواص فيزيكی:
به آن دسته از خواص گفته مي شود كه مشاهده و اندازه گيری آنها به توليد ماده جديد منجر نمی شود.
خواص فيزيكی: رنگ، بو، چگالی، نقطه ذوب، نقطه جوش و رسانايي (الكتريكی)
مثلا آب بي رنگ، بي بو و چگالی آن یک و در صفر درجه منجمد و در 100 درجه می جوشد و رسانایی الکتریکی ناچيز دارد.
ب) خواص شيميايی :
به مجموعه خواصي گفته مي شود كه تمايل يا عدم تمايل يك ماده به شركت در واكنش های شيميايی را بيان مي كند.
مثلا اشتعال پذيری خاصه بنزين و عدم اشتعال پذيری خاصه آب است.
نشانه تغییر شیمیایی :
هر تغيير شيميايی با نشانه اي همراه است.
اين نشانه حاكی از تشكيل يك ماده جديد می باشد البته بايد توجه داشت كه برخی از اين نشانه ها در تغيير فيزيكي هم ديده مي شوند.
برخی از نشانه هاي تغيير شيميايي عبارتند از :
الف) ظهور يك رنگ جديد مانند:
رنگ قهوه اي ‹————- قرار گرفتن ميخ آهني در محلول مس سولفات
رنگ آبي مايل به سياه ‹————- افزودن محلول يد به سيب زمينی
شيری رنگ ‹————— دميدن در آب آهك
ب) تشكيل يك ماده جامد مانند:
ماده جامد پنير مانند ‹————- افزودن سركه به شير
ج) تشكيل حبابهايی از گاز
حباب های گاز كربن دي اكسيد ‹——— ريختن جوهر نمك بر روي پوسته تخم مرغ
حباب های گاز كربن دي اكسيد ‹———- افزودن سركه به جوش شيرين
د: توليد گرما :
مانند حل شدن كلسيم كلريد در آب
همانطور كه گفته شد برخی نشانه ها در هر دو نوع تغيير مشاهده می شوند.
مثلا هنگامي كه در نوشابه گاز دار را باز مي كنيد و يا هنگامی كه آب را حرارت مي دهيد هم حباب هاي گاز ظاهر می شوند.
در اينجا تغيير شيميايی روي نداده است.
اجزاء يك تغییر شیمیایی :
هنگامی كه آهن در هوای مرطوب قرار مي گيرد، آهن با اكسيژن هوا تركيب می شود .
در نتیجه لايه قهوه ای يا نارنجی رنگ بر روي آن تشكيل مي شود كه زنگ آهن يا اكسيد آهن نام دارد. و یک تغییر شیمیایی روی داده است.
یا با سوختن شمع نیز تغییر شیمیایی صورت می گیرد . گرما و نور + بخار آب + گاز کربن دی اکسید<—- گاز اکسیژن + شمع( هیدروکربن)
در این تغییر شیمیایی، گاز اکسیژن و شمع که دچار تغییر شیمیایی می شوند، واکنش دهنده نامیده می شوند.
به بخار آب و گاز کربن دی اکسید، که در اثر تغییرشیمیایی تولید می شوند، فراورده می گویند.
در اثر سوختن چوب و گاز در فضای بسته یا اتاقی که هوا در آن جریان ندارد، علاوه برکربن دی اکسید و بخار آب، گاز کربن مونوکسید نیز تولید می شود.
کربن مونوکسید، گاز بی رنگ، بی بو و بسیار سمی و کشنده ای است.
هرگاه یک فردی به مدت چند دقیقه در معرض این گازقرار بگیرد، مسموم می شود و ممکن است جانش را از دست بدهد.
برای اینکه سوختن شروع شود به گرما نیاز داریم.
این گرما را می توان با استفاده از شعله ی کبریت یا جرقه فراهم کرد.
اگر فراورده واكنش زیر يعني آهن اكسيد با گاز ئيدروژن تركيب شود دو ماده جديد يعنی آهن و آب پديد می آيند.
توجه: هميشه واكنش دهنده در سمت چپ واكنش و فراورده در طرف راست واكنش قرار دارد.
سوختن:
نوعی از تغییرهای شیمیایی است كه طي آن يك ماده اشتعال پذير به سرعت با اكسيژن تركيب می شود.
ممكن است ماده اشتعال پذير مانند گاز شهری (متان) و يا يك نافلز مانند گوگرد و يا يك فلز مانند منيزيم باشد.
نتيجه آن توليد انرژی (گرما و نور) همراه با تركيبات اكسيژن دار است.
انرژی + بخار آب + كربن دی اكسيد ‹—————- اكسيژن + گاز متان
انرژی + گوگرد دی اكسيد ‹—————— اكسيژن + گوگرد
انرژي + منيزيم اكسيد ‹—————— اكسيژن + منيزيم
تند(احتراق):
با نور و گرمای شديد همراه است مانند سوختن منيزيم و يا احتراق مواد منفجره
كند(اكسايش):
نور و گرمای محسوس ندارد. مانند اكسيد شدن غذا در سلول های بدن- زنگ زدن آهن
بد نيست بدانيد كه گاهی بر اثر كمبود اكسيژن سوختن بصورت ناقص انجام مي شود.
در اين صورت علاوه بر كربن دی اكسيد و بخار آب مقداری گاز سمي كربن مونوكسيد (Co) هم تشكيل می شود.
اگر مقدار اكسيژن باز هم كمتر شود مقداری دوده هم تشكيل مي شود .
دوده شكلی از كربن است كه بصورت گرد نرمی از سوختن ناقص مواد سوختنی حاصل می شود.
از اين فراورده فرعی سوختن، جهت توليد رنگ ، جوهر خودكار ، بارور كردن ابرها و نيز در صنعت لاستيك سازي استفاده می شود.
توجه داشته باشيد كه برای وقوع تغییر شیمیایی احتراق همواره سه شرط لازم است
- مواد سوختنی
- گرمای کافی
- اکسیژن
بديهی است نبودن هر يك از این سه شرط، از وقوع اين تغيير شيميايی جلوگيری مي شود.
بنابراين هنگام ايجاد حريق به روش هاي مختلف،يكی از اين شرايط را حذف می كنند
- دور كردن مواد سوختنی از اطراف آتش
- دور كردن (حذف اكسيژن)
- سرد كردن (حذف گرما)
انرژي و تغييرات تغییر شیمیایی
مواد غذایی نیز مانند مواد دیگر، انرژی شیمیایی دارند به طوری که با سوزاندن آنها می توان گرما تولید کرد.
برای نمونه با گرمای آزاد شده از سوزاندن یک عدد بادام زمینی می توان مقداری آب را در یک لوله ی آزمایش به جوش آورد.
جانداران با سوزاندن مواد غذایی در بدن خود،انرژی مورد نیاز خود را برای دویدن، شکار کردن و… تأمین می کنند.
انسان ها نیز انرژی موردنیاز خود رابرای راه رفتن، فکر کردن، کار کردن و … با سوزاندن مواد غذایی ای به دست می آورند که می خورند.
می دانیم یک حبه قند آغشته به خاک باغچه، سریع تر می سوزد و به سوختن ادامه می دهد.
در خاک باغچه ماده ای هست که کمک می کند سوختن قند آسان تر انجام شود.
در بدن موجودات زنده نیز کاتالیزگرهای گوناگونی به نام آنزیم وجود دارند.
آنزیم ها سبب می شوند تغییرات شیمیایی در بدن موجودات زنده سریع تر انجام شوند.
گلوکز نیز در بدن موجودات زنده در حضور آنزیم با اکسیژن هوا ترکیب و ضمن آزاد کردن انرژی به کربن دی اکسید و بخارآب تبدیل می شود.
اگر فلزهای مس و آهن را در شرایط مناسب به طور غیر مستقیم به یکدیگر متصل کنید، می توانید انرژی الکتریکی تولید کنید.
در واقع شما با این کار، یک باتری می سازید.
در اینجا نیز تغییرهای شیمیایی رخ می دهند و انرژی شیمیایی مواد به انرژی الکتریکی تبدیل می شود.
اگر یک قرص جوشان را در آب بیندازید، تغییر شیمیایی رخ می دهد و قرص جوشان به مواد دیگری تبدیل می شود.
چگونه می توانید مشخص کنید که گاز تولید شده چیست؟
آیا از این تغییر شیمیایی می توان برای انجام دادن کار استفاده کرد؟
یک قوطی خالی فیلم را تا نیمه از آب پر کنید؛ سپس یک قرص جوشان را نصف کنید و درون آن بیندازید و در آن را محکم ببندید.
حال قوطی را وارونه روی زمین قرار دهید و کمی از آن فاصله بگیرید. چند ثانیه منتظر بمانید و مشاهدات خود را یادداشت کنید.
از این آزمایش چه نتیجه ای می گیرید؟
این آزمایش را با قرار دادن یک تخته پاک کن روی قوطی دوباره انجام دهید.
اگر تغییر شیمیایی در شرایط مناسبی انجام شود، می تواند کار انجام دهد و جسمی را جابه جا کند.
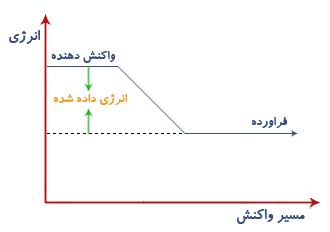
تغييرات گرماده علوم هشتم فصل 2 :
تغييراتي هستند كه با از دست دادن انرژي بصورت گرما همراهند، در اين گونه تغييرات انرژي واكنش دهنده ها بيشتر از انرژي فراورده هاست.
تغييرات گرماگير:
تغييراتی هستند كه با گرفتن انرژی (گرما) همراهند در اين تغييرات انرژی واكنش دهنده ها كمتر از فراورده هاست.
سرعت واكنش هاي شيميايي علوم هشتم فصل 2 :
تغییرهای شیمیایی با سرعت هاي متفاوتي انجام مي شوند.
سرعت تغییرهای شیمیایی يعني سرعت توليد فراورده ها و يا سرعت مصرف واكنش دهنده ها است.
به بيان ديگر سرعت واكنش شيميايي يعني «توليد فراورده يا مصرف واكنش دهنده در واحد زمان»
توجه داشته باشيد كه هر چه انرژي فعال سازی (حداقل انرژي لازم برای شروع واكنش) كمتر باشد سرعت تغییرهای شیمیایی بيشتر است.
الف) دما :
آب از هيدروژن و اكسيژن تشكيل شده است .
اين دو گاز در دماي معمولي هرگز با هم تركيب نمی شوند .
اما اگر مخلوط اين دو گاز را تا حدود 700 درجه سانتيگراد حرارت دهيم بسرعت با هم تركيب می شوند و آب پديد مي آيد.
ب) غلظت :
با افزايش غلظت برخورد مؤثر بين مولكول هاي واكنش دهنده بيشتر و واكنش سريعتر مي شود .
ج) كاتاليزگر:
کاتالیزگرها موادي هستند كه سرعت تغییرهای شیمیایی را افزايش مي دهند اما خود دچار تغيير شيميايی نمی شوند.
این مواد در پايان واكنش دست نخورده باقی می مانند.
مثلا هيدروژن پراكسيد (آب اكسيژنه) در گرما و نور به آب و گاز اكسيژن تجزيه می شود افزودن زنگ آهن سرعت تجزيه شدن را افزايش می دهد.
اگر مقداري گرد دی اكسيد منگنز به آب اكسيژنه اضافه كنيم سرعت واكنش بحدی افزايش مي يابد كه شروع به جوشيدن مي كند .
در نتیجه گرماي قابل ملاحظه ای ازاد می شود.(واكنش گرماده)
نمودار الف تجزيه اين ماده بدون حضور كاتاليزگر و نمودار ب تجزيه اين ماده با حضور كاتاليزگر را نشان می دهد.
د) سطح تماس:
با افزايش سطح تماس سرعت واكنش زيادتر می شود.
به همين علت است كه خاك اره سريع تر از تنه درخت می سوزد و يا خوب جويدن غذا هضم آن را آسانتر می كند.
فعاليت علوم هشتم فصل 2 :
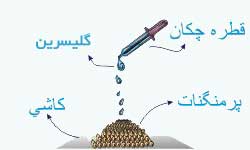
مقداري پر منگنات پتاسيم را روی تكه اي كاشی يا سنگ بريزيد. چند قطره گليسرين روي آن بچكانيد و چند لحظه صبر كنيد.
بار ديگر همين آزمايش را انجام دهيد اما اين بار قبل از چكاندن گليسرين ، پرمنگنات را در هاون كاملا نرم كنيد.
تفاوت نتيجه اين مرحله با مرحله قبل را تفسير كنيد.
تذكر: اين آزمايش را با احتياط و زير نظر بزرگتر ها انجام دهيد.
قانون پايستگي جرم در تغییرهای شیمیایی
لاوازيه در سال 1782 به اين نتيجه رسيد كه وقتی ماده ای به ماده ديگر تبديل می شود وزن كلي آن تغيير نمی كند .
به عبارت ديگر در تغییرهای شیمیایی همواره مجموع جرم واكنش دهنده ها برابر مجموع جرم فراورده هاست.
يعنی جرم ثابت باقی می ماند.
مثلا از سوختن چوب در هوا، موادي مانند كربن، دود، خاكستر، بخار آب و … پديد می آيد.
جرم كربن، دود ، خاكستر ، بخار آب و هوای مصرف شده برابر جرم چوب اوليه خواهد بود.
و يا اگر 4 گرم آهن و 7 گرم گوگرد را با هم حرارت دهيم حتما 11 گرم آهن سولفيد حاصل می شود.
















ممنونم از پاسخگوییتون استاد گرامی 🙏🙏
ممنونم از پاسخگوییتون استاد گرامی 🙏🙏
آیا انحلال اکسیژن در آب یک تغییر شیمیایی مفید هست؟
تغییر فیزیکی است زیرا ساختار مولکولی آن تغییری نکرده است فقط حل شده است
باسلام و وقت بخیر آیا وقتی بین سرکه و جوش شیرین واکنش انجام مشود جرم کاهش می یابد؟
بله بر اتر واکنش گاز تولید می شود و گاز از ظرف خارج می شود پس جرم ان کاسته می شود اما اگر ظرف دربسته باشد جرم تغییر نمی کند چون در واکنش های شیمیایی جرم ماده اولیه و جرم ماده تولید شده بر ابر است
فرمول تغییر شیمیایی که انجامکار داره چی هست؟
برای انجام کار باید نیرو در راستای جابجایی به جسم وارد شود و جسم جابجا شود پس کار برابر است با مقدار نیرو برحسب نیوتن ضربدر مقدار جابجایی بر حسب متر انرژی شیمیایی هم باید آزاد شود و به انرژی جنبشی تبدیل شود و توسط یک مبدل به نیروی لازم برای انجام کار تبدیل شود مثلا در یک موتور گزمایی مثل موتور اتومبیل بنزین بسوزد و انرژی شیمیایی آن آزاد شود و گاز گرم منبسط شده آن موجب حرکت اتومبیل شود و جابجایی صورت گیرد و کار انجام شود.